ヒト造血幹細胞によるヒト化マウス作製には、移植前にX線全身照射による骨髄抑制処置を行う必要がある。しかしながら、X線照射は個体に対してのダメージが大きく、特に腸管上皮細胞の顕著な脱落から、敗血症のリスクを伴う。 また、X線照射装置が飼育施設外に設置されている場合や、装置が常設されていない施設もあり、X線照射以外の骨髄抑制代替法をしばしばNOGマウスのユーザーから問われてきた。 そのため後述の論文にも報告され、ヒト化マウス作製のために用いられたBusulfan処置の効果を検証することにした。 検討には、① Busulfan至適濃度の検討 ② X線照射とBusulfan投与によるヒト化効率の比較を実施した。
① Busulfan至適濃度の検証
② ヒト造血幹細胞移植の生着能および分化能の検討
① Busulfan至適濃度の検証
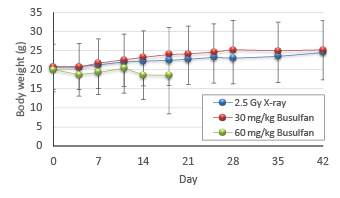
2.5 Gy X線照射群および30 mg/kg Busulfan投与群では、一時的に体重増加が停滞した後、徐々に体重の増加が認められる。60 mg/kg Busulfan投与群は、体重の減少が認められ、3週間以内に全個体が死亡した。従って、30 mg/kg Busulfan投与を至適投与量とした。
② X線照射とBusulfan投与によるヒト化効率の比較
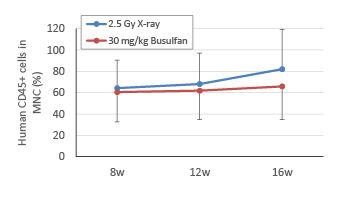
ヒト造血幹細胞移植後、8週・12週・16週目にイソフルラン麻酔下で採血し、抗ヒトCD45抗体を用いてヒト白血球を染色後、フローサイトメトリーにて解析した。2.5 Gy X線照射群および30 mg/kg Busulfan投与群ともに、同程度のヒト白血球の生着が認められた。
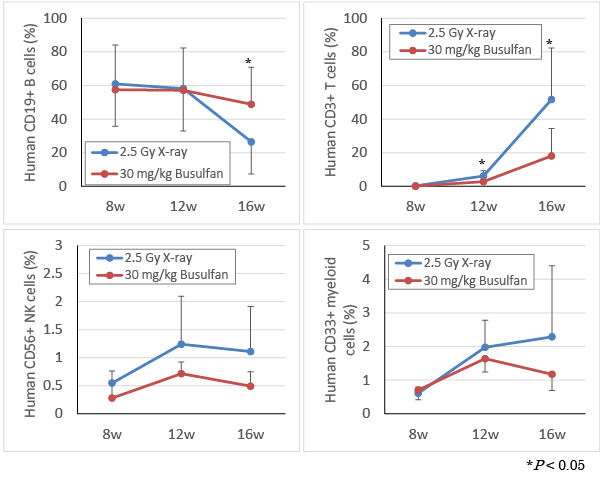
Figure 2と同様に、ヒト造血幹細胞移植後、8週・12週・16週目にイソフルラン麻酔下で採血し、各種抗ヒト抗体を用いてヒト細胞を染色後、フローサイトメトリーにて解析した。2.5 Gy X線照射群および30 mg/kg Busulfan投与群ともに、ヒトCD19+ B細胞・CD3+ T細胞・CD56+ NK細胞およびCD33+ Myeloid細胞の分化が認められた。またBusulfan投与後のヒトT 細胞は、X線照射に比べて緩やかに分化し、一方でヒトB細胞の割合が亢進した。
従来のX線照射による骨髄抑制方法と同様に、Busulfan処置によってもヒト造血幹細胞が同等に生着し、各種ヒト免疫細胞分化が認められた。またX線照射に比べ、T細胞分化の遅延とB細胞分化の亢進が認められた。この結果は過去の文献の報告(Choi B. et al. J Clin Immunol 2011, 31(2):253-64)とほぼ同様であった。
以上の結果から、Busulfan処置がX線照射の代替法としてヒト化マウス作製に利用できることが明らかとなった。
PAGE TOP