ヒト末梢血を移植する方法
未処置のマウスにヒト末梢血単核球(hPBMC)を移入する方法
注)移入後は、ヒトT細胞の増加に比例して徐々にGVHDが発症します。
GVHD発症を回避するためにNOG-MHC classI, II KO(NOG-ΔMHC)マウスも作製しています。
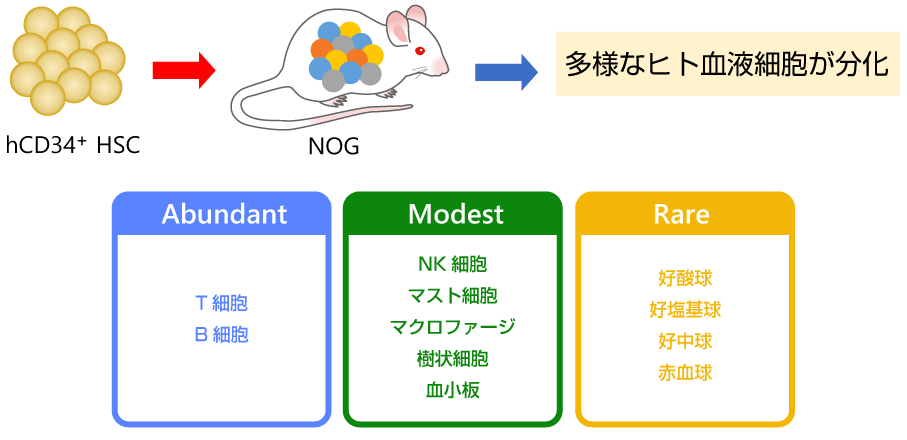
*NOGマウスでは、T、B細胞は効率良く分化するが、ミエロイド系細胞やNK細胞の分化が十分ではない。
| No. | 次世代NOGマウス系統名 | 特徴 | アプリケーション | 論文 |
|---|---|---|---|---|
| 1 | NOG-EXL (NOG-hGM-CSF/hIL-3) |
ヒトミエロイド細胞分化亢進 |
アレルギー がん免疫 感染症研究 |
Ito R et al. J Immunol 2013 |
| 2 | NOG-W41 |
ヒト細胞高生着性モデル |
ヒト血液 免疫細胞関連研究 |
|
| 3 | NOG-IL6 |
ヒトMDSC/TAM 分化亢進 |
がん免疫研究 |
Hanazawa A et al. Front Immunol 2018 |
| 4 | NOG-IL2 |
NK細胞分化亢進 (CD34+ HSC由来) |
がん免疫研究 |
Katano I et al. J Immunol 2015 Hanrik J et al. Nat Commun 2017 |
| 5 | NOG-IL15 |
NK細胞分化亢進 |
がん免疫研究 |
Katano I et al. Sci Rep. 2017 |
6〜12週齢のNOGマウスへ放射線照射 (<2.5 Gy)
またはブスルファン(30-40 mg/kg, ip)処置
5x104個のヒト臍帯血由来CD34陽性細胞(hCD34+ HSC)を静脈より移入
hCD34+ HSC移入後
1ヶ月以降>>> ヒト単球・B細胞分化
3ヶ月以降>>> ヒトT細胞分化

NOGマウスの血中ではヒトCD45+細胞が良く生着し、CD3+ T細胞・CD19+ B細胞の分化も認められます。
NOG-EXL(NOG-hGM-CSF/hIL-3)マウス

hCD34+ HSC移入後16週頃からヘマトクリットの顕著な低下が認められます。
分化したヒトマクロファージが肝臓にてマウス赤血球を貪食していることに起因すると考えられています。
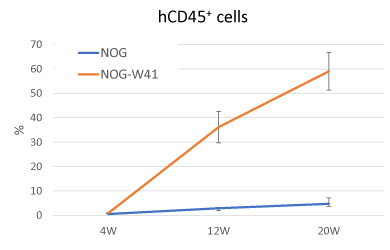
NOG-W41(NOGW)マウス ---ヒト細胞高生着性モデル
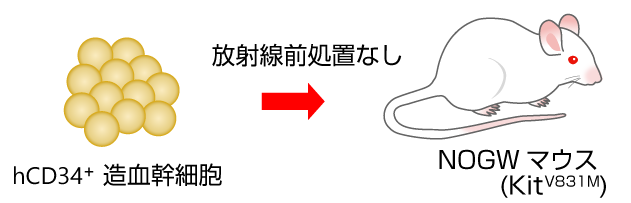
NOGWマウスは、放射線処置をせずにhCD45+細胞の高い生着率が認められました。このことから、移植細胞数を減らしたり、生着し難い細胞分画のホスト動物として様々な移植研究への応用が期待されています。
PAGE TOP